臨床研究(倫理指針)
臨床研究の実施について
多機関共同研究(参加)の場合
多機関共同研究(参加)で中央一括審査を行う研究の実施については「中央一括審査を受けた研究の実施について(実施許可の手続き)」をご確認ください。
研究開始までの流れ
多機関共同研究に参加する場合は下記の点を事前に確認してください。
- 研究責任者、分担者に十分に研究を実施する時間的余裕があること
- 研究対象者が確保できること
- 当院が当該研究の実施要件を満たしていること(実施体制や人員、事務的な手続きも含む)
- 当院の研究責任者、研究分担者が研究者の要件を満たしていること

- 倫理審査体制(中央一括審査(参加)or 個別審査)
⇒ 中央一括審査(参加)の場合は コチラ
- 研究計画書
⇒ 研究代表者から提供された研究計画書をそのまま提出 - 長崎大学病院が共同研究機関であることが分かる資料(共同研究機関一覧など)
研究計画書内に記載してある場合は不要 - 同意説明文書あるいは情報公開文書
⇒ 研究代表者から提供された文書を元に、長崎大学病院用に編集して提出 - 審査結果通知書
- その他、別紙、添付資料として取り扱われる資料
- 提供された同意説明文書・情報公開文書を元に作成する場合は、別途長崎大学病院用の作成日、版数をつけてください。
(申請マニュアル)
【申請書類に関する注意事項】
- 修正履歴・コメントは全て削除してください。
- 代表機関から提供された資料のファイル名は変更しないでください。
委員会開催日の3週間前の水曜日、17:00
事前チェックの期間も踏まえて、余裕をもって申請してください。
- 研究計画の内容
- 同意説明文書、情報公開文書の内容
- 申請書類の整合性
- 研究者等の要件
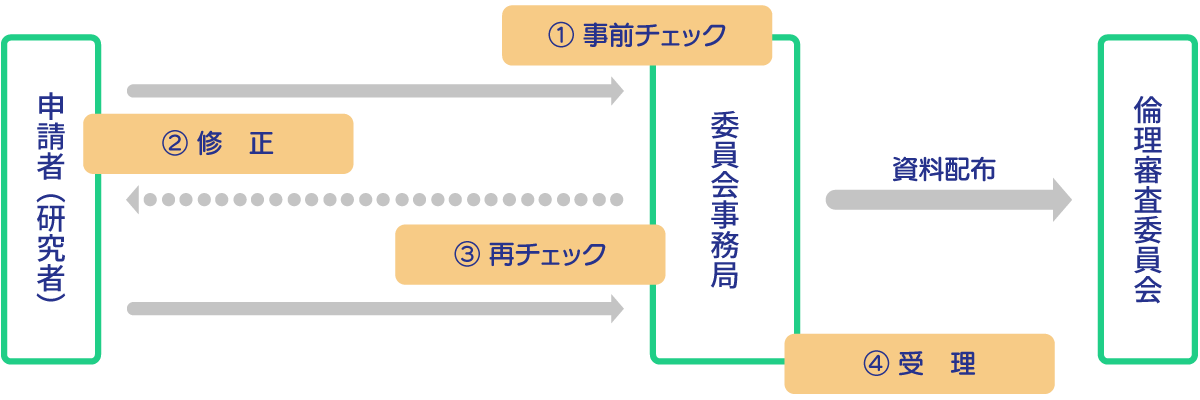
| 事前チェックの流れ | |
|---|---|
| ① | 必要な書類が提出されているのを確認したら、委員会事務局が事前チェックを開始します。 (システム上の申請状況の表示は「保留」) 事前チェックの内容は6営業日以内に、申請者へ差し戻します。 (システム上の申請状況の表示は「申請NG」) |
| ② | 申請者は事前チェックの内容を確認、対応後に再申請してください。 事前チェック内容はCTポータルの「申請情報一覧」⇒「課題名」⇒「コメント履歴」から確認できます。 |
| ③ | 委員会事務局が再申請された書類を再度確認します。 未対応、新たに指摘事項等があれば6営業日以内に差し戻します。 受理されるまで①~③を繰り返します。 |
| ④ | 事前チェックが完了したら、倫理審査委員会審議資料として受理します。 (システム上の申請状況の表示は「申請受理」) 受理後の書類の修正、差し替えは原則受け付けません。 どうしても修正、差し替えが必要な場合は病院教育研究支援課(内線:2503)へお問い合わせください。 |
- 研究内容に不明な点、確認事項がある場合は臨床研究センターより「確認書」を添付して差し戻します。
- 「確認書」に記載してある内容について研究代表者へ回答するように依頼してください。
- 再申請の際に、研究代表者が回答した「確認書」を添付してください。
病院長の実施許可(許可書発行)の手続きを行います。
【委員会からコメントがある場合】
開催日から約●営業日以内にに、電子申請システム(CTポータル)より差し戻しが行われます。
研究者は委員会からの内容を確認し、指定日までに対応をお願いします。
必ず、病院長の許可を得られたことを研究代表者へ報告してください。
研究者は許可書が手元に届いたのを確認してから研究を開始してください。
研究実施中の手続き
- 研究計画書に従って実施すること
(研究計画書に記載されていないことは実施しない) - 病院長が許可した範囲(申請書の記載内容)を超えて研究を実施しないこと
(例:症例数や研究分担者、その他、研究計画書等に記載がなく、確認書や補遺を元に許可した内容) - 研究計画に変更が生じる場合は、変更が生じる前に変更申請の手続きを行うこと
- 研究の進捗状況は随時確認し、申請した症例数を超えないように管理すること
- 人事異動などに伴う研究者(特に研究責任者)の不在や研究者以外の研究行為が行われないように管理すること
病院長の許可日を起点に1年に1回、研究の実施状況(症例数、逸脱の有無、有害事象等の発生状況)を報告してください。
研究代表者より研究全体の実施状況報告を受けた場合は併せて報告してください。
○ 報告に必要な資料は コチラ ![]()
下記の場合は、研究代表者からの依頼がなくても変更が生じる前に変更申請を行なってください。
- 研究分担者の変更
- 長崎大学病院の担当症例数の変更
- 問い合わせ先などの変更
研究責任者の変更の場合は、まず、研究代表者へ変更申請の依頼を行ってください。
(審査のタイミング等で変更に時間を要する場合は、先に長崎大学病院において研究責任者の変更を行う旨、研究代表者に伝えてください。その後、研究代表機関において倫理審査委員会の手続きが完了したら改めて変更申請をお願いします。)
毎月第3月曜日 16:30~
病院長の実施許可(許可書発行)の手続き行います。
【委員会からコメントがある場合】
開催日から約5営業日以内にに、電子申請システム(CTポータル)より差し戻しが行われます。
研究者は委員会からの内容を確認し、指定日までに対応をお願いします。
病院長の実施許可手続きが完了したら、申請者宛に倫理審査結果通知書、許可書、利益相反審査結果通知書を送付します。
必ず、病院長の許可を得られたことを研究代表者へ報告してください。
研究者等は、侵襲を伴う研究の実施において重篤な有害事象の発生を知った場合には研究代表者、倫理審査委員会、病院長への報告が必要です。
研究計画書、手順書に従い、速やかに報告してください。
実施された研究との因果関係の有無を問わず、研究対象者に生じた全ての好ましくない又は意図しない傷病若しくはその兆候(臨床検査値の異常も含む)
有害事象のうち、次に掲げるいずれかに該当するものをいう。
- 死に至るもの
- 生命を脅かすもの
- 治療のための入院または入院期間の延長が必要となるもの
- 永続的又は顕著な障害・機能不全に陥るもの
- 子孫に先天異常を来すもの
当院で発生した事象と他機関で発生し事象の申請区分が異なるのでご注意ください。
下記のような事実を知った場合、速やかに臨床研究センター 管理ユニットへ連絡の上、研究代表者、倫理審査委員会、病院長へ不適合・逸脱報告を行ってください。
重大か否かは問いません。
- 研究データの改ざん、捏造
- 規制・研究計画書・手順書の不遵守
- 研究責任者、分担者以外による研究実施(同意取得や研究介入など)
- 病院長が許可した範囲を超えての研究実施
- 試料・情報の不適切な取り扱い
- 対象者の人権や安全性に影響を及ぼす事象(可能性も含む)
- 研究結果の信頼性を損なうような事象(可能性も含む)
- 研究に関する情報、個人情報等の漏えい
併せて長崎大学病院の手順にも従う必要があるため、必ず臨床研究センター管理ユニットへ報告を行い、指示に従ってください。
他の研究機関で発生した不適合・逸脱の報告を受けた場合は研究代表者の指示に従い、倫理審査委員会へ報告してください。
研究終了(中止)後の手続き
研究代表者から当該研究終了の連絡を受けたら、研究終了(中止)報告書を提出してください。
○ 報告に必要な資料は コチラ ![]()
「対象者がいない」等の理由で研究への参加終了(中止)を希望する場合は研究代表者に確認、承諾を得てください。
研究に用いられた試料・情報は研究代表者の指示あるいは研究計画書に定めた方法に従って保管してください。
研究者が異動、退職した後も研究計画に定められた期間までは定められた場所での保管義務が生じます。
予めご了承ください。

